Метод фотометрического определения антибиотикорезистентности изолятов и микробных ассоциаций, концепция его использования.
ГНУ ИЭВСиДВ
Леонов С.В., Афонюшкин В.Н., Коптев В.Ю.
Общеизвестно, что привыкание микроорганизмов к антибиотика происходит с большей скоростью, нежели получение и внедрение новых антибактериальных препаратов
[1]. Следовательно важно уделять внимание и другим сторонам соперничества ученых и микроорганизмов, а именно, совершенствованию использования антибактериальных веществ. Безусловно без современной диагностики это нереально. Поэтому мы работаем над созданием фармако-диагностических связок - методиками получения диагностической информации сцепленной с конкретными схемами лечения или профилактическими мероприятиями.В рамках этой работы мы изучили возможность использования микротитровальных плашек и ветрикального спектрофотометра типа "Диагност" для определения оптической плотности культур бактериальных клеток растущих в лунках плашек в присутствии антибактериальных веществ
.Первым этапом работы являлось изучение чувствительности этого прибора. Чтобы избежать погрешностей эталонных приборов, при построении калибровочной кривой, мы делали серию разведений суспензии 12 часовой культуры E.Coli JM103 (см. табл №1). В каждом разведении объем растворителя увеличивали на 10%. Растворителем служила МПБ. На каждое разведение отводили 6 лунок. Объем проб составлял 200 мкл.
Таблица №1
Оптическая плотность серии разведений суспензии бактериальных клеток.
|
% суспензии |
100 |
100 |
90 |
80 |
70 |
60 |
50 |
40 |
30 |
20 |
10 |
|
Экстинкция М +м |
0,272 +0,0016 |
0,258 +0,0016 |
0,23 +0,0025 |
0,224 +0,0041 |
0,216 +0,004 |
0,194 +0,0032 |
0,132 +0,0046 |
0,088+0,00302 |
0,06+0,036 |
0,046+0,0048 |
0,035+0,023 |

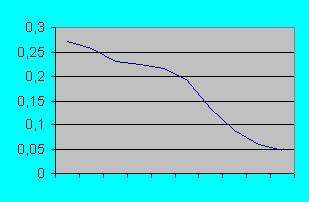
График №1 Кривая экстинкции калибровочных разведений суспензии бактерий.
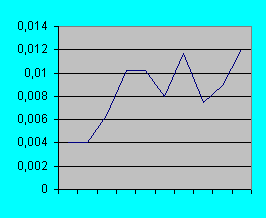
График№2 изменение стандартного отклонения при увеличении разведения
Опыты показывают отчетливое уменьшение оптической плотности при увеличении разведения бактериальной суспензии (см. график №1). Одновременно имеется тенденция к увеличению стандартного отклонения (см.график №2). Однако при многократном замере одной и той же пробы стандартное отклонение было нулевым (до третьего знака после запятой). Следовательно причиной явились погрешности при разведении суспензии.
Следующий этап работы - отработка практического использования тест-системы и данных полученных с ее помощью. В настоящее время мы используем концентрации антибактериальных веществ в максимальных терапевтических концентрациях для данного вида животных. Конфигурация плашек следующая - по
вертикаль вносим антибиотики, по горизонтали - пробы. Последний вертикальный ряд - контроль без антибиотиков. Как правило поступившие на исследование пробы подвергаются стандартному бактериологическому исследованию и подтитровке на антибиотики методом диффузии в агар. После этого в плашки с предварительно внесенными антибиотиками разливаем по 200 мкл МПБ и высеваем антибиотико-резистентные штаммы из зон задержки роста и интактную микрофлору. Целью является изучение адаптации микрофлоры к антибиотикам. Селекция наиболее стабильных антибиотиков. Подбор антибиотиков запаса. Плашки закрываем пленкой и культивируем 8 часов при 37оС. по истечении этого срока проводим фотометрию и расчет подавления роста по сравнению с контролем. Интактная микрофлора служит критерием изменения антибиотико-чувствительности после обработки тем или иным антибиотиком.В ходе испытания тест-системы на полевых штаммах микроорганизмов были получены следующие результаты. Сальмонеллы, после обработки ветофлоком приобрели чувствительность к ампициллину, канамицину , арговиту (препарат серебра) и карбенициллину; после обработки цефазолином – к ампициллину и левотетрасульфину; после амоксиклава и амоксициллина – к канамицину, арговиту, зинацефу и байтрилу; после офлоксацина – к абакталу и арговиту. Также были выделены и негативные схемы последовательного применения данной группы лекарственных веществ. Так, после применения амоксиклава и амоксициллина сальмонеллы стали менее чувствительны а ампициллину и тилану. После применения левомицетина пастелеллы, выделенные от больных телят, стали резистентны к гентамицину, ампициллину, левотетрасульфину, стрептомицину и полимиксину.
Обсуждение и выводы
. Мы считаем, что в ряде случаев к бактериологическому исследованию следует подходить прагматически. Рассматривать результаты следует через призму их влияния на действия врача, исходя из этого, следует определять и задачи бактериологического исследования.Высокая штаммовая вариабельность патогенности внутри вида, наличие мобильных генетических детерминант патогенности и антибиотикоустойчивости, различная способность разных видов бактерий к росту на разных питательных средах, высокая активность межвидового взаимодействия, в ряде случаев, снижают ценность определения видового состава микрофлоры
[2,3].В
связи с этим, необходимо определение факторов патогенности микрофлоры, механизмов защиты от антибактериальных препаратов и чувствительности к ним [4]. Все остальное мы считаем целесообразным привязывать к этим данным и не более того. Разумеется, это не относится к видам, обладающим высокой патогенностью и вирулентностью, но и не исключает дополнительного использования наших критериев.Например, может возникнуть потребность разделения микрофлоры на составляющие компоненты, такое разделение мы проводим по функциональному признаку, но макро- и микро- морфология колоний позволяет облегчить этот процесс, служа дополнительным маркером.
Возможен индивидуальный подход при использовании наших данных - в процессе лечения отдельного животного можно последовательно применять рекомендуемые нами антибиотики (в случае если лечение первым антибиотиком не дает излечения или процесс затягивается). Групповой подход заключается в лечении группы животных одним антибиотиком, а после того как он перестанет действовать, следующим по схеме
.К циркуляции антибиотикорезистентных штаммов в хозяйстве необходимо подходить с эпизоотологических позиций. Применяя, какую либо терапевтическую схему, в какой либо группе животных, мы рекомендуем ограничить миграцию устойчивых к данному антибиотику микроорганизмов в другие группы. Принцип разрыва эпизоотической цепочки здесь не менее эффективен. Важно знать какие антибиотики применять в разных технологических группах. Либо использовать антибиотики общие для всех групп. А потом их заменять на новые в тех
группах, где чувствительность к старым антибиотикам понизилась, не допуская циркуляции устойчивых к новым антибиотикам штаммов внутри хозяйства. Все схемы антибиотикотерапии не должны использоваться одновременно, вразнобой во всех технологических группах. Необходимо планировать последовательность смены антибиотиков. Перспективен поиск эффективных циклов замены антибиотиков. Если используются, одновременно несколько схем, мы рекомендуем привязывать разные схемы, к разным изолированным группам животных не допуская одномоментного перекрестного использования этих схем.. Лечение разных патологий разными антибактериальными препаратами в одной технологической группе, должно учитывать наши данные. Так как возможна, например, селекция и последующая миграция ампициллинустойчивого штамма с телят переболевших диспепсией на телят с бонхитами, со всеми вытекающими последствиями. Эти последствия можно и нужно учитывать, подбирая лечебные схемы с этих позиций.Анализируя полученные результаты можно сделать вывод, что жесткие схемы применения антибактериальных препаратов не дают должного эффекта ввиду высокой изменчивости патогенных микроорганизмов, следовательно необходимы гибкие схемы антибиотикотерапии, основанные на своевременной и точной диагностике, ориентированной на практику.
Список литературы:
